Laboratoire Biologie Fonctionnelle et Adaptative (BFA) :
Equipe Myologie Fondamentale et translationnelle
http://bfa.univ-paris-diderot.fr/equipe-4/
http://bfa.univ-paris-diderot.fr/equipe-4/
Sabrina BATONNET-PICHON, Florence DELORT, Alain LILIENBAUM
Filaments intermédiaires, Myopathies, Mécanobiologie, Agrégats protéiques, Stress oxydants, adhésion, migration
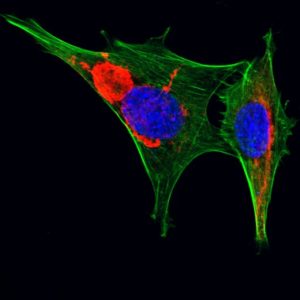
Nous nous focalisons principalement sur le rôle physiopathologique de la desmine, et de certains de ces partenaires.
La desmine appartient à la grande famille des filaments intermédiaires qui forment le troisième réseau indispensable du cytosquelette avec les microfilaments d’actine et les microtubules. Les filaments intermédiaires sont généralement tissus spécifiques. La desmine est ainsi uniquement exprimée dans les trois types de muscle (lisse, cardiaque et squelettique) et est indispensable au maintien de l’intégrité musculaire. Dans le muscle squelettique adulte, la desmine se trouve sous forme de réseau au niveau de la strie Z. Cependant, elle est exprimée dès les stades précoces et se retrouve dans les myoblastes indifférenciés sous la forme d’un réseau de filaments étendu dans le cytoplasme et plus dense près du noyau.
Il faut savoir qu’il n’existe aucune drogue réellement spécifique bloquant ou activant la polymérisation des filaments intermédiaires, en particulier de la desmine, contrairement aux filaments d’actine ou aux microtubules. Ainsi dans nos études, nous utilisons différents mutants localisés dans chaque partie de la desmine (tête, queue ou domaine central) pour altérer sa fonction. De plus, de manière à optimiser nos résultats, nous étudions plus particulièrement des mutants pathologiques, connus pour être liés à des pathologies musculaires squelettique et/ou cardiaque. Cependant, chaque mutation peut plus ou moins perturber la formation du réseau de desmine (perte de l’expression, formation d’agrégats ou non…) et donc induire ses propres mécanismes moléculaires, indépendamment de la région où il se situe, d’où l’intérêt d’analyser plusieurs types de mutations.
Ainsi, pour étudier le rôle physiologique de la desmine, nous avons dû établir de nouveaux modèles cellulaires et animaux (isogéniques) tels que des lignées de cellules C2C12 surexprimant stablement différentes mutations de la desmine, une souris Knock-In-R405W porteuse d’une mutation sévère chez les patients. Et plus récemment, à l’aide de la technologie CRISPR/cas9 des myoblastes humains immortalisés soit invalidés, soit knock-in pour une mutation (criblage en cours).
Ces dernière années, nous avons ainsi pu mettre en évidence un rôle de la desmine dans les propriétes mécaniques et la contractilité des cellules musculaires en collaboration avec l’équipe de S. Hénon. Nous avons également démontré un lien entre la polymérisation de la desmine et le stress oxydant. Enfin plus récemment (2022), nous avons pu mettre en évidence un rôle de la desmine dans l’adhésion et la migration cellulaire (à l’aide d’image de microscopie confocale, TIRFM, ou de videomicrosopie, et la mise au point de test d’adhérence sous flux : voir les vidéo ci-dessous).
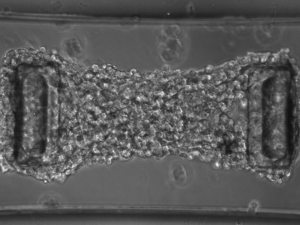
Actuellement nous poursuivons nos investigations en développant en collaboration avec M.Reffay, ou T.Boudou (Grenoble) des système 3D de formations de microtissus musculaire, l’étude comparative de modèles de desmine KO ou KI (en collaboration avec R. Schroeder et C. Clement en Allemagne) à l’aide d’analyse RNAseq et protéomiques, et enfin nous développons de nouveaux système d’analyse de l’effet de l’exercice physique en collaboration avec C. Goupil
[1] Hakibilen C., Delort F., Daher M.T., Joanne P., Cabet E., Cardoso O., Bourgois-Rocha F., Tian C., Rivas E., Madruga M., Ferreiro A., Lilienbaum A., Vicart P., Agbulut O., Hénon S.and Batonnet-Pichon S. Desmin modulates muscle cell adhesion and migration. Front. Cell Dev. Biol., 2022 doi: 10.3389/fcell.2022.783724
[2] J Absence of Desmin Results in Impaired Adaptive Response to Mechanical Overloading of Skeletal Muscle. Front Cell Dev Biol. 2021 Jul 15;9:662133. doi: 10.3389/fcell.2021.662133. eCollection 2021.
Dual Functional States of R406W-Desmin Assembly Complexes Cause Cardiomyopathy With Severe Intercalated Disc Derangement in Humans and in Knock-In Mice. Circulation. 2020 Dec;142(22):2155-2171. doi: 10.1161/CIRCULATIONAHA.120.050218.
Alterations of redox dynamics and desmin post-translational modifications in skeletal muscle models of desminopathies.Exp Cell Res. 2019 Oct 15;383(2):111539. doi: 10.1016/j.yexcr.2019.111539.
The desmin network is a determinant of the cytoplasmic stiffness of myoblasts. Biol Cell. 2018 Apr;110(4):77-90. doi: 10.1111/boc.201700040.
Mutation in the Core Structure of Desmin Intermediate Filaments Affects Myoblast Elasticity. Biophys J. 2017 Aug 8;113(3):627-636. doi: 10.1016/j.bpj.2017.06.020.
Distinct Fiber Type Signature in Mouse Muscles Expressing a Mutant Lamin A Responsible for Congenital Muscular Dystrophy in a Patient. Cells. 2017 Apr 24;6(2):10. doi: 10.3390/cells6020010.
Myofibrillar Myopathies: New Perspectives from Animal Models to Potential Therapeutic Approaches. J Neuromuscul Dis. 2017;4(1):1-15. doi: 10.3233/JND-160203.
Beyond mice: Emerging and transdisciplinary models for the study of early-onset myopathies.Semin Cell Dev Biol. 2017 Apr;64:171-180. doi: 10.1016/j.semcdb.2016.09.012.
Cardiac arrhythmia and late-onset muscle weakness caused by a myofibrillar myopathy with unusual histopathological features due to a novel missense mutation in FLNC. Rev Neurol (Paris). 2016 Oct;172(10):594-606. doi: 10.1016/j.neurol.2016.07.017.
Desmin Mutation in the C-Terminal Domain Impairs Traction Force Generation in Myoblasts. Biophys J. 2016 Jan 19;110(2):470-480. doi: 10.1016/j.bpj.2015.11.3518.
Antioxidant Treatment and Induction of Autophagy Cooperate to Reduce Desmin Aggregation in a Cellular Model of Desminopathy. PLoS One. 2015 Sep 2;10(9):e0137009. doi: 10.1371/journal.pone.0137009. eCollection 2015.
N-acetyl-L-cysteine prevents stress-induced desmin aggregation in cellular models of desminopathy. PLoS One. 2013 Oct 1;8(10):e76361. doi: 10.1371/journal.pone.0076361. eCollection 2013.
Cyclic stretch reveals a mechanical role for intermediate filaments in a desminopathic cell model. Phys Biol. 2013 Feb;10(1):016001. doi: 10.1088/1478-3975/10/1/016001.