Laboratoire Biologie Fonctionnelle et Adaptative (BFA) :
Equipe Myologie Fondamentale et translationnelle
http://bfa.univ-paris-diderot.fr/equipe-4/
http://bfa.univ-paris-diderot.fr/equipe-4/
Ana FERREIRO, Anne Filipe, Isabelle DUBAND-GOULET, Maryline MOULIN, Andrew HO, Justine MEUNIER
Myopathies congénitales, Stress oxydant, cycle cellulaire
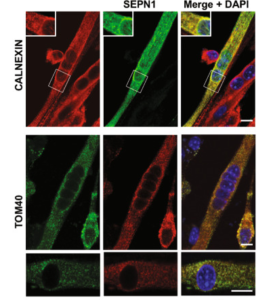
Image de Filipe et al, Cell death diff, 2021
Les myopathies congénitales sont des maladies génétiques rares, hétérogènes, qui se manifestent en général dès la naissance par une faiblesse musculaire pouvant être associée à une cardiomyopathie et/ou à une insuffisance respiratoire potentiellement fatales. Aucun traitement n’est disponible à présent. Notre équipe développe des recherches multidisciplinaires à l’interface clinique/fondamentale sur les myopathies congénitales, afin d’identifier de nouveaux phénotypes homogènes, leurs gènes responsables, les mécanismes physiopathologiques impliqués et des cibles thérapeutiques qui nous permettront de développer des traitements pharmacologiques.
Nous nous intéressons particulièrement aux myopathies à cores, qui sont caractérisées par la présence de zones de déplétion en mitochondries et désorganisation sarcomérique au sein des fibres musculaires des patients. Par des collaborations internationales, nous avons réuni des séries de cas, défini plusieurs différentes formes phénotypiques et trouvé leurs bases génétiques par l’identification de mutations des gènes codant la titine, le récepteur à la ryanodine de type 1, ASC-1 ou la sélénoprotéine N (SEPN1/SELENON, qui ensemble sont à l’origine de la plupart des cas de myopathies à cores.
Le rôle de SEPN1 étant inconnu, nous avons développé des études physiopathologiques et moléculaires, en utilisant :
– des cellules (cultures primaires de fibroblastes et de myoblastes) de patients dépourvus de sélénoprotéine N
– une lignée de myoblastes murins C2C12, sauvage et knocked-down pour SEPN1
– des souris KO SEPN1
– des outils moléculaires pour analyser la structure de SEPN1, ses partenaires protéiques et sa localisation subcellulaire. Ainsi, nous avons généré des protéines SEPN1taggées par Myc et GFP étant donné qu’aucun des Acs anti- SEPN1, y compris ceux que nous avons générés, ne marche en immunocytochimie. Nous avons aussi prédit et cloné les différents domaines de SEPN1afin de clarifier leurs rôles précis, et commencé à y introduire les mutations humaines pour des études d’interaction protéique et d’activité enzymatique in vitro.
Ces outils nous ont permis de prouver que SEPN1a un rôle clé dans la défense antioxydante et de tester différents antioxydants, avec des retombées translationnelles intéressantes. En effet, nous avons prouvé que le phénotype des cellules dépourvues de SEPN1est complètement restauré par l’antioxydant N-acétylcystéine, qui est donc le premier traitement efficace ex vivo. Nous avons par la suite effectué une étude préclinique avec NAC sur la souris KO SEPN1 qui a confirmé l’efficacité de ce traitement in vivo. Ces découvertes ont débouché sur la mise en place d’un premier essai thérapeutique chez l’humain. Nous sommes actuellement en train d’optimiser l’étude de biomarqueurs sur nos modèles cellulaires pour ouvrir la voie à la recherche de drogues thérapeutiques utilisant des approches à haut débit.
D’autre part, nous avons identifié une nouvelle forme de myopathie congénitale grave, associée à des mutations du gène TRIP4, codant ASC-1. ASC-1 est au cœur d’un complexe protéique, coactivateur transcriptionnel, dont la fonction est très peu connue. Nous avons cloné ce gène et généré une forme taggée de la protéine afin de surmonter la non-spécificité des anticorps disponibles et d’étudier le rôle de cette protéine dans le développement et la fonction musculaire, sur des C2C12 et des cultures primaires de myoblastes murins et humains.
A l’avenir nous allons utiliser ces outils continuer nos recherches multidisciplinaires sur les maladies musculaires allant du phénotype au gène au mécanisme à la cible et au traitement, comme nous l’avons en partie fait pour la myopathie associée à SEPN1. Dans cette maladie rare, nous proposons pour la première fois un médicament ciblant le mécanisme physiopathologique primaire dans une myopathie héréditaire, ce qui sera une preuve de concept importante quant à l’intérêt des traitements pharmacologiques basés sur la physiopathologie dans les maladies génétiques. Nous allons aussi poursuivre nos recherches sur le stress oxydant, et son implication dans le développement, les cellules souches, l’épigénétique, les maladies musculaires ou le vieillissement. Ceci aura des implications mécanistiques et thérapeutiques applicables à d’autres organes et d’autres maladies, qui iront bien au-delà du domaine des maladies rares.
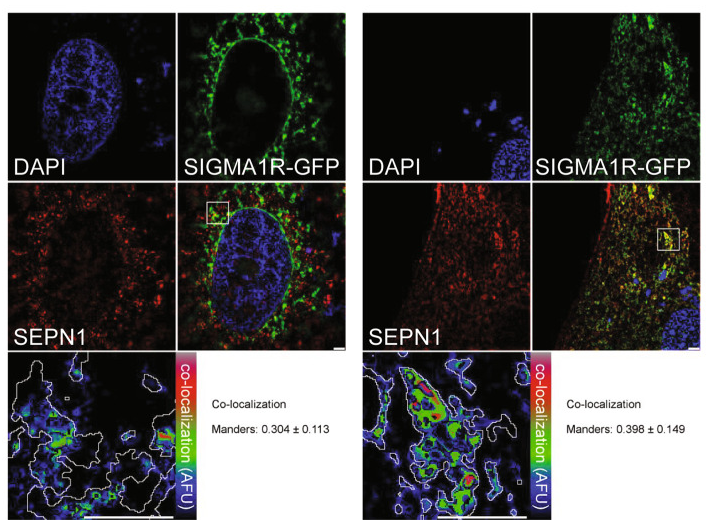
Co-localization of SEPN1-Flag (red) and Sigma 1-R-EGFP (a MAM marker, green) in C2C12 (right panel) and HeLa cells (left panel). The lower-right panel displays the merged image of the two stains. The lower-left panels display the SEPN1 signal overlaid with MAMs (MAM boundaries are highlighted in gray) in a rainbow lookup table (LUT). MAMs-SEPN1: Manders coefficient for SEPN1 staining was calculated as the proportion of SEPN1 signal overlapping with the Sigma 1-R marker.
Image de Filipe et al, Cell Death Diff., 2021
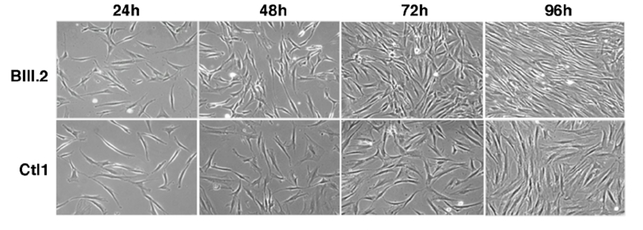
Accelerated proliferation and reduced G0/G1 phase of the cell cycle in patient fibroblasts.
Bright-field pictures of control (Ctl1) and patient (BIII.2) fibroblasts cultures from 24 to 96 hours after seeding
Image de Vilar-Quiles et al, Ann Neurol, 2020
[1]